
新闻动态
News Information
-
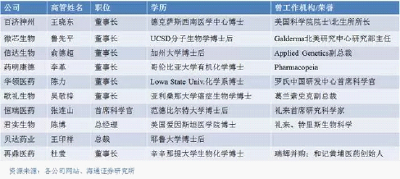
- 特点分析 | 中国创新医药研发企业赴美上市研究
赴美上市的创新药企大多都在美国、澳大利亚、欧盟等境外医药研究发达市场开展药品注册和临床试验,这样就可以减少重复临床试验,提高效率,降低研发费用,大大缩短新药申请注册和最终上市的时间。

-
- 总局办公厅公开征求《药品审评审批信息公开管理办法(征求意见稿)》意见
请有关单位和个人于2018年2月21日前通过电子邮件进行反馈。审评审批结果信息公开第十四条 对批准上市的创新药、改良型新药和仿制药,药审中心应当在药品批准上市后60个工作日内,公开技术审评信息。

-
- 习近平主持深改组会议审议通过了《关于改革完善仿制药供应保障及使用政策的若干意见》
新华社北京1月23日电 中共中央总书记、国家主席、中央军委主席、中央全面深化改革领导小组组长习近平1月23日下午主持召开中央全面深化改革领导小组第二次会议并发表重要讲话。
-
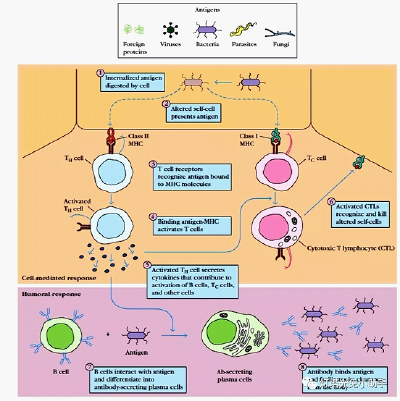
- 抗体种类千千万,你知道原因么?
此时VH基因片段保持不变,而发生CH基因节段的重排,即结合抗原的特异性相同,但其重链类型(恒定区)发生改变。可以说,自然界有多少种抗原物质,人体就能产生多少种免疫球蛋白分子,就能形成多少种抗体。
-
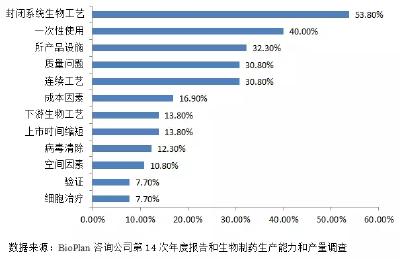
- 2018年影响生物药生产的生物工艺趋势展望—生产效率占据首位
在全球经济发展的背景下,生物制药行业一直致力于改进生物工艺(Bioprocessing)技术,以降低成本并提高生产效率。 随着美国生物类似药市场的打开,全球生物类似药产品的研发趋势似乎正在加速。




